Predisposición a la piel atópica: últimos descubrimientos
Preámbulo
DESCUBRIMIENTOS DEL PROGRAMA EV.E.I.L.S.
Fisiología de la piel de los niños comparada con la de los adultos
Desarrollado por Laboratorios Expanscience, el programa EV.E.I.L.S. (EValuation of the Early Infant Life: the Skin) comprende una serie de estudios sin precedentes en el mundo y realizados en los últimos diez años.
Este programa de investigación sobre la piel de un niño desde el nacimiento hasta los 2 años, examinó la superficie externa de la piel hasta las células madre epidérmicas y ha permitido 3 descubrimientos importantes.
Entre el nacimiento y los 2 años:
El estrato córneo, que garantiza la función de barrera de la piel, expe- rimenta un proceso de maduración.
Inmaduro en el nacimiento, alcanza una etapa inicial de madurez desde el segundo año de vida.
La piel está deshidratada y el equilibrio hídrico está alterado.
El suministro de células madre es máximo en el momento del nacimiento, pero es extremadamente vulnerable a las agresiones externas.
Es por eso que es necesario proteger e hidratar la piel a diario desde el nacimiento y durante los dos primeros años de vida.
Mustela®, un experto en la piel de los niños durante más de 60 años, está lle- vando a cabo nuevas investigaciones para comprender mejor las necesidades y las características específicas de la piel de los lactantes.
Para satisfacer mejor las necesidades específicas de la piel con predisposición atópica, Mustela® ha colaborado para lanzar un nuevo programa de investigación EV.E.I.L.S., dedicado a la piel de lactantes y niños con predisposición atópica.
Este dossier científico le presenta:
- Nuevos marcadores implicados en la dermatitis atópica.
- Una nueva propuesta preventiva para la dermatitis atópica, desde el naci- miento, y sus primeros resultados.
Con este conocimiento más profundo de la piel de los niños más pequeños, Mustela® ofrece una nueva generación de productos para el cuidado de la piel STELATOPIA®: una gama diseñada específicamente para calmar y restaurar los lípidos de la piel de lactantes y niños con predisposición a la atopia.
Los productos están clínicamente demostrados por su eficacia, garantizados por su alta tolerancia desde el nacimiento y están probados bajo control dermatológico y pediátrico.
Dermatitis atópica del lactante y el niño
La dermatitis atópica (DA) es la enfermedad crónica de la piel más común en los niños.
Se caracteriza por brotes pruriginosos de eccema agudo sobre una piel crónicamente seca.
La DA afecta a los lactantes en la gran mayoría de los casos, pero también puede afectar a los niños. La persistencia de DA hasta la edad adulta es rara.
A. Fisiopatología
La DA es una dermatosis en la que los dos principales mecanismos fisiopatológicos son una alteración de la barrera epidérmica y una inflamación de la piel del tipo hipersensibilidad retardada(1), que involucra a la inmunoglobulina E (IgE) y a una subpoblación de linfocitos T cooperadores tipo 2 (Th2).
Estos dos mecanismos (deterioro de la función de barrera e inflamación de la piel) están estrechamente relacionados y se refuerzan mutuamente.
El deterioro de la barrera epidérmica conduce a la entrada de alérgenos ambientales, que inducen una reacción inmunológica seguida de una respuesta inflamatoria de la piel. Mientras tanto, la respuesta inflamatoria contribuye y agrava el deterioro de la función de la barrera de la piel.
- Factores inmunológicos
Habitualmente la DA (o DA extrínseca) ocurre sobre una base atópica. En una persona, la base atópica se caracteriza por la tendencia del sistema inmunológico a desarrollar una reacción de hipersensibilidad a alimentos comunes y antígenos ambientales(2).
Desde un punto de vista inmunológico, la DA se parece a una reacción de hipersensibilidad retardada que involucra linfocitos T y células presentadoras de antígenos(1,2,3).
Se pueden distinguir tres fases en la DA:
- Fase de sensibilización a un alérgeno ambiental: es asintomática y puede durar varios meses
o varios años. Conduce al crecimiento y a la activación de una población de linfocitos T específica para el alérgeno. - Fase de activación de las lesiones de la DA: la entrada del alérgeno en la piel provoca la activación de los linfocitos Th2 que luego liberan determinadas citoquinas. Esta fase de inicio de la lesión es seguida por una fase crónica, que involucra linfocitos Th1. El desequilibrio en la respuesta Th1/Th2 a favor de la exacerbación de la respuesta inflamatoria Th2 es una característica clave de la DA(1).
- Fase de resolución de las lesiones de DA, durante la cual la inflamación se controla. La DA se caracteriza por episodios de exacerbación inflamatoria seguidos de resolución espontánea. En la actualidad, se sabe poco sobre los mecanismos que causan que las lesiones inflamatorias se resuelvan de forma espontánea.
- Deterioro de la barrera epidérmica
La función de barrera cutánea se ve afectada en los sujetos con DA. Muchos estudios muestran que la pérdida de agua transepidérmica (TEWL, por sus siglas en inglés) es particularmente alta en pacientes con DA. Clínicamente la piel está seca (xerosis) y escamosa, lo que provoca escozor, incluso en ausencia de erupción(2).
La alteración de la barrera epidérmica se debe, al menos en parte, a mutaciones en los genes que codifican proteínas del estrato córneo. La principal mutación encontrada en la DA afecta a la filagrina, una proteína necesaria para formar el estrato córneo y que participa en la hidratación: la proteólisis de la filagrina conduce a la producción de Factores Hidratantes Naturales (NMF, por sus
(2) siglaseninglés) .
Los defectos de la barrera también están asociados con la sobreexpresión de otros marcadores, como la calicreína 7, que ayudan a exacerbar algunos signos clínicos de la DA (xerosis, descamación y prurito) y la deficiencia de ceramida en las capas superiores de la epidermis
Piel normal de niño
- Durante la maduración
- Frágil/vulnerable

Piel infantil atópica
- Barrera cutánea deteriorada/Falta de integridad
- Entrada de alérgenos/ Reacción inflamatoria

B. Aspectos clínicos
- Síntomas
El inicio de la DA es muy común aproximadamente a la edad de 3 meses, y algunas veces a partir de las primeras semanas de vida, con síntomas que incluyen:
- Síntomas cutáneos lesiones eccematosas con eritema, edema, excoriación y supuración. Sequedad de la piel y, después de los 2 años, la liquenificación es común.
- Prurito: constante después de la edad de 3 meses, el prurito a menudo es clínicamente evidente por la presencia de excoriaciones y después de 2 años, por liquenificación.
- Diagnóstico
La DA se diagnostica con base en los criterios de diagnóstico del Grupo de Trabajo
del Reino Unido:
Criterio obligatorio: piel pruriginosa o los padres informan que el niño se rasca o se frota.
Combinado con al menos 3 de los siguientes criterios:
- Una historia personal de dermatitis que involucra a las flexuras o las mejillas en niños menores de 10 años de edad.
- Antecedentes personales de asma o fiebre del heno (o antecedentes de enfermedad atópica en un familiar de primer grado para niños menores de 4 años).
- Una historia de piel generalmente seca durante el último año.
- Eccema visible de las flexuras o eccema de las mejillas, frente y cara externa de las extremidades en niños menores de 4 años.
- Inicio de síntomas cutáneos antes de los 2 años (un criterio que se puede aplicar solo a pacientes mayores de 4 años).
- Evaluación de la severidad
La gravedad de la DA se puede evaluar utilizando varios sistemas de puntuación clínica. El más utilizado en Europa es el SCORAD (puntuación de la dermatitis atópica , siglas en inglés). Tiene en cuenta la intensidad de los signos clínicos, el tamaño del área afectada de la piel y la gra- vedad de los signos funcionales (prurito y alteraciones del sueño)(1,3).
SCORAD se calcula según 3 parámetros(9):
A = extensión de las lesiones en la piel (%).
B = Intensidad de los siguientes 6 criterios (graduado de 0 a 3): eritema, edema / pápulas, supuración / costras, liquenificación, excoriaciones y seque- dad de la piel.
C = Evaluación del prurito y la pérdida del sueño mediante escalas analógicas visuales.
- SCORAD = A/5 + 7B/2 + C
- SCORAD < 15: dermatitis atópica ligera – 15 < SCORAD < 40 : dermatitis atópica moderada
- SCORAD > 40: dermatitis atópica severa
C. Progresión y complicaciones: la marcha atópica
En la mayoría de los casos, la DA aparece sobre una predisposición atópica. Según la Organización Mundial de la Salud (OMS), la atopia se define como la tendencia a presentar una respuesta inmunológica anormal a ciertos alérgenos. Se puede manifestar de diferentes maneras: eccema atópico, alergia a los alimentos, asma o rinitis alérgica. En los últimos años, muchos estudios muestran vínculos estrechos entre la DA, el asma y la rinoconjuntivitis alérgica.
De hecho, en los lactantes y, posteriormente, en los niños, especialmente los niños con DA, la enfer- medad atópica sigue una progresión típica conocida como marcha atópica. Esto se caracteriza por la progresión de una enfermedad alérgica a otra.
Progresión de enfermedades infantiles con la edad
La enfermedad atópica sigue un curso bastante típico en lactantes y niños (10):
- eccema atópico desde los primeros meses de vida,
- seguido de asma que empieza entre la edad de 2 a 4 años,
- y finalmente rinitis alérgica en edades posteriores.

En comparación con otros, un niño con DA tiene mayor riesgo de desarrollar posteriormente asma alérgica y rinoconjuntivitis(11).
Dicha progresión se relaciona principalmente con las formas más graves de DA, pero la existencia de una «marcha atópica» de este tipo plantea algunos desafíos.
Lo más importante es saber hasta qué punto es posible prevenir la DA para limitar la progresión a las manifestaciones respiratorias de la atopia.
Nuevas áreas de investigación in vitro
A. Papel de los Staphylococcus aureus y su biopelícula en la DA
Actualmente se cree que un millón de bacterias, que representan cientos de especies diferentes, colonizan cada cm2 de piel. Cuando está en equilibrio, este microbioma desempeña un papel activo y pro- tector al limitar la proliferación de bacterias patógenas. Sin embargo, ciertas enfermedades o condiciones externas cambian la composición de la flora cutánea.
- Colonización por Staphylococcus aureus y el empeoramiento en la DA
Hoy en día, varios estudios han demostrado diferencias entre el microbioma de la piel de pacientes atópicos y el de personas no atópicas.
Colonización crónica de la piel atópica por Staphylococcus aureus
Prevalencia de Staphylococcus aureus(17)
Piel normal (10%)
Piel atópica:
- Áreas con lesiones (70%), áreas sin lesiones (39%)
- Aumento durante las erupciones(18)
Los estudios también han demostrado que la colonización por Staphylococcus aureus podría desempeñar un papel en el círculo vicioso fisiopatológico de la DA.

- La biopelícula de los Staphylococcus aureus
Recientemente, también se ha descrito la importancia de la biopelícula en la DA, especialmente la de Staphylococcus aureus(19).
Atención
Una biopelícula se define como una comunidad estructurada de microorganismos que se adhieren y unen a una superficie. Se encuentran encapsulados en una matriz exopolisacárida protectora y adhesiva que ellos sintetizan. Esta particular organización de la bacteria les permite cooperar entre ellos y protegerse de ataques externos.
Biopelícula bacteriana:
- Aumenta la resistencia a los antibióticos de 50 a 500 veces.
- Aumenta la virulencia del organismo.
En la piel atópica, los Staphylococcus aureus se adhieren a la piel dañada y forman biopelículas.
Se ha demostrado que en pacientes con DA, una biopelícula compuesta de Staphylococcus aureus, presente en el infundíbulo de las glándulas exocrinas culmina con el bloqueo real de los conductos sudoríparos, que podría ser la causa del clásico prurito inducido por el calor(20).
La presencia de esta biopelícula también podría ser responsable de la insensibilidad a los antibió- ticos sistémicos y a la activación local de la inmunidad innata, con la producción de citoquinas proinflamatorias, particularmente TNFα y mediadores pruritogénicos(19).
B. E.V.E.I.L.S. Un nuevo programa in vitro, sin precedentes e innovador
- Stelaskin® modelo de respuesta a los Staphylococcus aureus
Nosotros elaboramos un modelo epidérmico in vitro que reproduce la colonización de la piel atópica por los Staphylococcus aureus.
Microscopía electrónica de barrido (x1500)
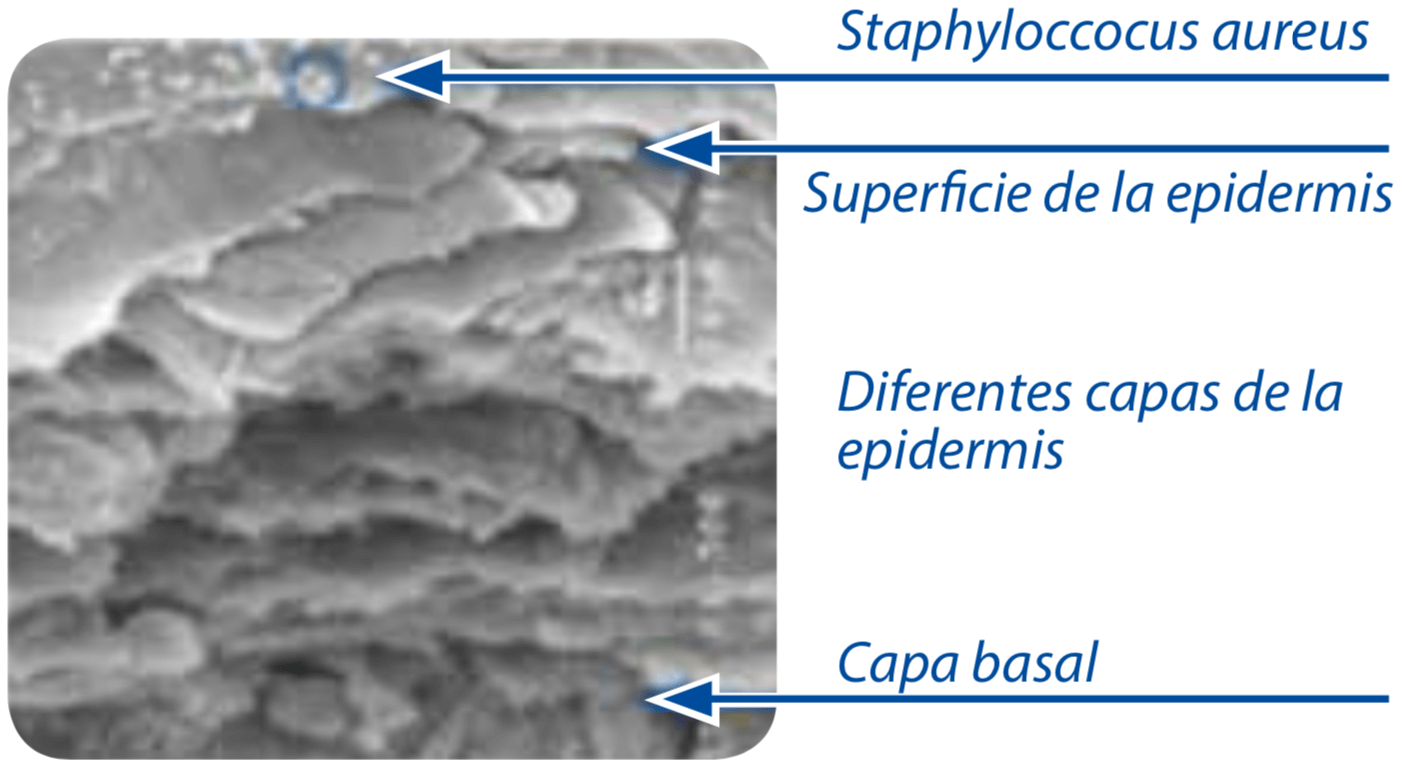
Para crear este modelo epidérmico, que reproduce la epidermis de la piel atópica, los investigadores de Laboratoires Expanscience:
- inocularon la epidermis reconstruida con una cepa de Staphylococcus aureus (MRSA: meticilina resistente a Staphylococcus aureus, siglas en inglés);
- luego realizaron el co-cultivo de esta epidermis con células del sistema inmunológico (monocitos THP1), lo que permite reproducir una respuesta mediada por mecanismos inmunitarios que activa la respuesta Th2.
IMPACTO DE LA COLONIZACIÓN DE STAPHYLOCOCCUS AUREUS EN LA PIEL ATÓPICA
La inmunidad innata y la capacidad de la re- generación de la epidermis dañada son métodos esenciales de defensa contra los ataques cutáneos experimentados por la piel atópica del niño.
Por lo tanto, decidimos estudiar el impacto de la colonización por Staphylococcus aureus en la expresión de ciertos marcadores genéticos de inmunidad cutánea y de células madre:
- TLR2: un receptor involucrado en el reconocimiento de patógenos y en la inducción de la respuesta inmunológica.
- Queratina 19: un marcador de la pro- liferación de células madre.
- Integrina α6, integrina β1: receptores celulares implicados en la comunicación intracelular, en la adhesión de las células a la matriz extracelular y en la regulación de la proliferación y diferenciación de células madre.
DESCUBRIMIENTO PRINCIPAL N°1: DISMINUCIÓN DE LA INMUNIDAD INNATA

La inmunidad innata, la primera línea de defensa contra los agentes infecciosos o los patógenos, es una respuesta rápida e inespecífica que permite que el microbioma se mantenga en equilibrio y limita la entrada de organismos patógenos.
La expresión de TLR2 se reduce fuertemente. La colonización por Staphylococcus aureus del modelo de piel atópica Stelaskin® reduce la capacidad de la piel para defenderse contra la colonización por estas bacterias.
El bálsamo emoliente STELATOPIA® restaura las capacidades naturales de defensa de la piel.
El bálsamo emoliente STELATOPIA® restaura las capacidades naturales de defensa de la piel. Estudio realizado en Piel Atópica STELASKIN® (1 año) – Modelo 2: Staphylococcus aureus. Se midió el nivel de expresión de TLR2.
DESCUBRIMIENTO PRINCIPAL N°2: DISMINUCIÓN EN EL COMPLEMENTO DE CÉLULAS MADRE EPIDÉRMICAS

Las células madre basales están involucradas en el mantenimiento de la homeostasis de la piel. La protección de las células madre es, por lo tanto, crucial para limitar el efecto nocivo de las agresiones externas.
El complemento celular de la epidermis de Stelaskin que imita la piel atópica se ve muy afectado. La expresión de los marcadores de células madre es muy reducida, en comparación con la de la piel normal.
STELATOPIA® Bálsamo Emoliente restaura la integridad de los marcadores de células madre.
Estudio realizado con Piel Atópica STELASKIN® (1 año) – Modelo 2: Staphylococcus aureus. Se midió el nivel medio de expresión de KRT19, ITGA6 e ITGB1.
- Modelo de la respuesta a la biopelícula de los Staphylococcus aureus
La presencia de biopelículas en la superficie de la piel se ha descrito en diferentes enfermedades: acné, rosácea y, más recientemente, DA(20). Para estudiar la cinética de la formación de las biopelículas después de la colonización bacteriana y medir el efecto de los emolientes sobre la limitación de su desarrollo, los investigadores de los Laboratorios Expanscience reprodujeron un modelo de la epidermis reelaborada a partir de piel atópica colonizada por una biopelícula de Staphylococcus aureus.
Las superficies de la epidermis reelaborada a partir de la piel atópica se observaron mediante microscopía electrónica después de la inoculación con una cepa de Staphylococcus aureus (MRSA).
DESCUBRIMIENTO PRINCIPAL N°3: FORMACIÓN RÁPIDA DE LA BIOPELÍCULA PIEL ATÓPICA DE STAPHYLOCOCCUS AUREUS
PIEL ATÓPICA
A partir de las 6 horas, adherencia de las bacte- rias a la superficie y formación de biopelículas.

Después de 24 horas de incubación, la superficie está completamente colonizada por la biopelícula.
Una nueva aproximación preventiva desde el nacimiento
A. Régimen de tratamiento estándar para la DA
El tratamiento estándar para la DA es sintomático y a largo plazo. Sus objetivos son aliviar al niño durante los períodos de brotes mediante la reducción de la inflamación y el prurito, y evitar recurrencias a través del tratamiento a largo plazo(1,2).
a.Tratamiento de las erupciones inflamatorias: corticosteroides tópicos
Los corticosteroides tópicos, el tratamiento estándar para las exacerbaciones de la DA, tienen tanto acción antiinflamatoria e inmunosupresora como antimitótica. En la práctica, se administran una vez al día durante un período corto, usualmente de 4 a 8 días, hasta que haya una mejora obvia. En condiciones normales de uso, los corticosteroides tópicos rara vez causan efectos secundarios locales en niños.
Sin embargo, son objeto de un grado de fobia por parte de los padres.
- Protección tópica a largo plazo
Los emolientes son la base de la protección tópica para la DA y el principal tratamiento utilizado para prevenir las erupciones(3).
Su eficacia contra la xerosis ha sido claramente demostrada.
El objetivo de este tratamiento de apoyo es restaurar la barrera cutánea para que sea menos permeable a los alérgenos ambientales y para reducir el prurito mediante la lucha contra la xerosis(1,2,3).

B. Nueva aproximación específica: prevención de la DA desde el nacimiento
La DA es una afección común de la piel que se está volviendo cada vez más prevalente en los niños. La DA afecta actualmente del 10 al 30% de los niños(12,13).
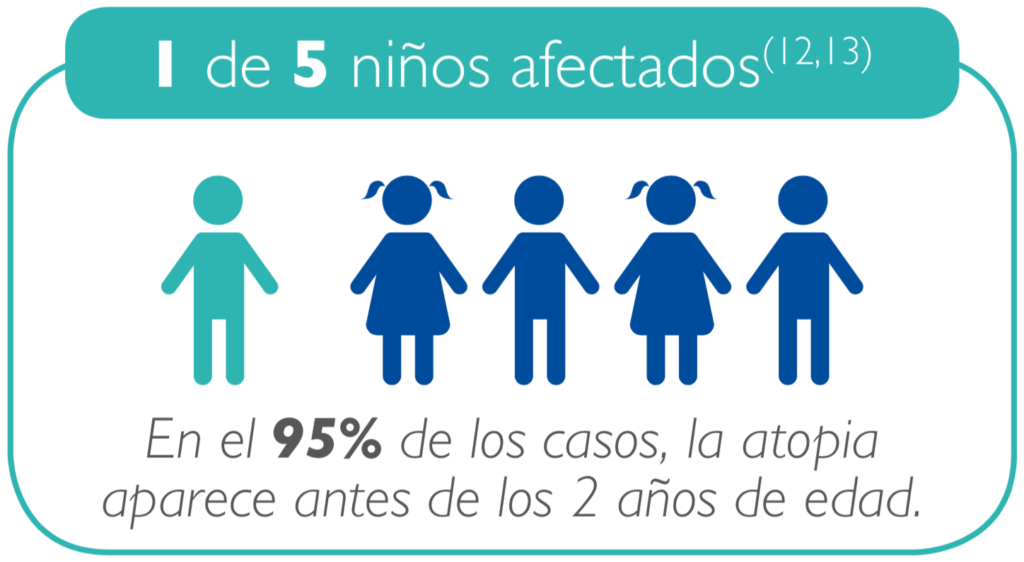
Esta creciente prevalencia enfatiza la necesidad de ofrecer pro- puestas complementarias para los cuidados en el tratamiento de la DA en los lactantes y niños desde su nacimiento.
El factor genético es el primer factor de riesgo que se debe considerar. El riesgo no solo está relacionado con la historia de DA en los padres, sino que también incluye otras formas de atopia (asma, fiebre del heno).
Como es una enfermedad de origen parcialmente genético, la DA es un padecimiento hereditario.
De hecho (2, 14) :
- La presencia de un familiar atópico aumenta en más de dos veces el riesgo de desarrollar DA.
Esto corresponde de 40 a 50% de riesgo para desarrollar la enfermedad cuando 1 familiar es atópico. - La presencia de 2 familiares atópicos aumenta en más de 3 veces el riesgo de desarrollar DA. Esto corresponde de 50 a 80% de riesgo para desarrollar DA cuando dos familiares son atópicos.

La naturaleza hereditaria de la DA hace posible ofrecer a los padres interesados propuestas para la atención preventiva desde el nacimiento, teniendo en cuenta la historia familiar y las probabilidades de que ocurra una DA en el lactante y el niño.
En particular, la DA se puede tratar temprano, con una eficacia significativa, mediante la aplicación de emolientes al niño.
De hecho, estudios recientes han demostrado que la aplicación del emoliente, desde el nacimiento y durante los primeros 6 a 8 meses de vida, en niños con riesgo de desarrollar DA (es decir, con un familiar atópico, que ha tenido DA o que tiene asma o fiebre del heno) hace posible reducir el desarrollo de la DA entre un 33 a 50%(15,16).
Por lo tanto, estos resultados demuestran el interés por establecer una aproximación preventiva desde el nacimiento para la DA, mediante el uso de cuidados con emolientes en todos los niños considerados en riesgo, incluso antes de que aparezcan los signos clínicos.
C. Nuevo programa de investigación clínica EV.E.I.L.S. sobre el enfoque preventivo desde el nacimiento
Después de estos descubrimientos científicos, para medir la eficacia de los cuidados de la piel con STELATOPIA® en el desarrollo de DA en niños en riesgo, Mustela inició un estudio clínico con 113 recién nacidos durante 9 meses.
113 recién nacidos con 2 familiares atópicos Fuerte probabilidad de desarrollar DA: 50 – 80%

UNA APLICACIÓN DIARIA DE UN PRODUCTO STELATOPIA®
DESDE EL NACIMIENTO REDUCE LA PROBABILIDAD DE AUMENTO DE LOS SÍNTOMAS CLÍNICOS DE LA DA A LOS 9 MESES
EN 51%
* Ninguno o 2 tubos pequeños para la aplicación local
D. Aproximación preventiva: un programa innovador en 130 departamentos de maternidad en Francia
Basándose en el compromiso de los profesionales de la salud de proporcionar atención experta que satisfaga las necesidades de cuidados de la piel de todos los niños desde su nacimiento, los Laboratorios Expanscience establecieron un programa de asociación sin precedentes en 2016 en 130 departamentos de maternidad.
Un esquema integral con respaldo experto.
DISCUSIÓN EN MESA REDONDA MULTIDISCIPLINARIA EN ATOPIA
«Proteger e hidratar la piel de los niños desde el nacimiento: ¿cuáles son los beneficios?»
Reunión e intercambios entre médicos y expertos médicos afines sobre las prácticas actuales.
CAPACITACIÓN Y SENSIBILIZACIÓN EN DEPARTAMENTOS DE MATERNIDAD
Organización de sesiones de capacitación para equipos médicos y médicos afines en 130 departamentos de ma- ternidad en Francia.
DISTRIBUCIÓN DE UNA HERRAMIENTA DE DIAGNÓSTICO DEL RIESGO ALÉRGICO, DESDE EL NACIMIENTO
Distribución de cuestionarios en los departamentos de maternidad que brindan información sobre la detección, así como sobre la importancia de la prevención.
SUMINISTRO DE PRODUCTOS Y MUESTRAS EN LOS DEPARTAMENTOS DE MATERNIDADES
Debido a que 1 de cada 5 niños está en riesgo de desarrollar DA, Mustela proporciona productos de sus dos líneas, a los departamentos maternidad:
20% de los productos de la línea STELATOPIA® de Mustela, 80% de los productos de Mustela línea de piel normal.
NUEVOS DESCUBRIMIENTOS DEL PROGRAMA DE APROXIMACIÓN PREVENTIVA EV.E.I.L.S.
A través del programa de investigación clínica desarrollado para niños con una gran probabilidad (50- 80%) de desarrollar DA, hemos sido capaces de evaluar clínicamente la eficacia de la aproximación preventiva con nuestras nuevas fórmulas para pieles atópicas en niños con riesgo.
STELATOPIA, una nueva línea para la piel con tendencias atópicas
Una nueva línea cosmética basada en la experiencia dermatológica de Laboratorios Expanscience, formulada con ingredientes que han sido meticulosamente seleccionados con prioridad a los ingredientes de origen natural.
A. Una combinación de 2 ingredientes naturales patentados
PERSEOSA DE AGUACATE (*)
- Fortalece la cohesión y la organización de la barrera: +32% Ceramidas(a) +49% Involucrinas(b)
- Mantiene la hidratación de la epidermis: +175% de transglutaminasa(c) +47% ácido hialurónico(d)
- Mantiene el complemento de las células madre epidérmicas: 80% De integrina α6 conservada después de la exposición a los rayos UV(e)
OLEODESTILADO DE GIRASOL
- Activa los receptores PPARα
- Restaura el nivel de expresión de filagrina +77% de filagrina(f)
- Regula el nivel de expresión de calicreína -77% calicreína(f)

(*) Excepto aceite de baño.
(a) Análisis por cromatografía en capa fina de ceramidas extraídas de la epidermis reelaborada con esterasa.Tratamiento de 72 horas con Perseosa de Aguacate®.
(b) Determinación de involucrina por ELISA en queratinocitos epidérmicos humanos normales como una proporción del número de células vivas estimadas mediante
la prueba de MTT. Tratamiento de 48 horas con Perseosa de Aguacate®.
(c) Transglutaminasa inmunomarcada en explantes de piel después de la deslipidación usando una mezcla de éter/acetona.Tratamiento por 3 horas con
Perseosa de Aguacate®.
(d) Análisis ELISA de ácido hialurónico en un medio de cultivo de queratinocitos epidérmicos humanos normales como la proporción del número de células vivas
estimadas por análisis de rojo neutro. Tratamiento por 24 horas con Perseosa de Aguacate®.
(e) Integrina alfa 6 inmunomarcada en implantes de piel sometidos a UV.Tratamiento con Perseosa de Aguacate 24 horas antes y después de la irradiación UV.
(f) Cultivo de explantes de piel humana tratados con Stelatopia durante 24h y estimulados con un cóctel de citoquinas Th2 durante 24h.
B. Una línea completa con eficacia clínica demostrada
NUEVAS FÓRMULAS STELATOPIA®

La eficacia de las fórmulas de Mustela STELATOPIA® se ha probado clínicamente bajo supervisión dermatológica.
(*) Estudio clínico realizado con el bálsamo y la crema emoliente. Eficacia percibida en la disminución de la comenzón, autoevaluación bajo supervisión dermatológica en 40 lactantes y niños con piel propensa a la atopia durante un período de 21 días.
C. Fórmulas de alta tolerancia, hipoalergénicas*, sin fragancia
La formulación de los nuevos productos de la gama STELATOPIA® de Mustela responde a estatutos internos de formulación, ambiciosos y vinculados con nuestros estrictos requisitos y criterios de seguridad, mientras mantiene formas de dosificación que cumplen con los requisitos de nuestros consumidores en términos de texturas, eficacia y un alto grado de naturalidad.
Además del estricto marco regulatorio de la norma ISO 22716 y el cumplimiento de buenos estándares de fabricación, imponemos un control muy estricto de los ingredientes seleccionados, en todas las etapas del desarrollo y antes de la comercialización.

D. Productos 100% ecodiseñados
INGREDIENTES DE FUENTES VEGETALES
Política de procesamiento responsable de plantas como Perseosa de Aguacate®: ético, obtención responsable respetuosa con la biodiversidad
(miembro de UEBT * desde 2011). * Union for Ethical BioTrade.
FUENTE DE LOS ENVASES
El cartón utilizado para el embalaje proviene de bosques gestionados de manera sostenible, y la tinta está hecha de aceites vegetales.
Reducción del peso de la botella: 72 toneladas de plástico ahorradas en el año 2014.
PRODUCTO FINAL
Botellas y cajas reciclables(1).
Fórmulas de lavado con espuma biodegradables(2).
PRODUCCIÓN
Reducción en el consumo de energía (3).

TRANSPORTE/DISTRIBUCIÓN
Reducción del impacto ambiental a través de la optimización de rutas, ya que el sitio de producción está ubicado a 800 m del depósito
de almacenamiento.
El sitio en Épernon (Francia), certificado ISO 14001, está involucrado en la iniciativa (establecida por Laboratorios Expanscience® con respecto a su I + D y actividades de producción).
(1) Criterios de clasificación del mercado francés.
(2) Método 3028 de la OCDE.
(3) 2010-2015, en el sitio web de Épernon, para 700 unidades producidas.

Bibliografía
1 – Société Française de dermatologie. Prise en charge de la dermatite atopique de l’enfant. Conférence de consensus. Conférence plénière le Mercredi 20 Octobre 2004, Institut Pasteur, Paris.Texte des recomman- dations (version texte court).
2 – Taïeb A. Dermatite atopique. In: Dermatologie et infections sexuellement transmissibles. Saurat, Grosshans, Laugier, Lachapelle, 5ème édition, Masson,2008.
3 – Centre de R & D – Laboratoire Expanscience, Le Maître M. Dermatite atopique du nourrisson et de l’enfant in Dermatite atopique. Nouv. Dermatol. 2007 ; 26 : Suppl 1 : 1-16.
4 – Cork MJ. et al. Epidermal barrier dysfunction in atopic dermatitis. J Invest Dermatol 2009 ; 129 : 1892-1908.
5 – Elias PM, Schmuth M. Abnormal skin barrier in the etiopathogenesis of atopic dermatitis. Curr Allergy Asthm R 2009 ; 9 : 265-272.
6 – Roedl D. et al. Serine protease inhibitor lymphoepithelial Kazal type-related inhibitor tends to be decreased in atopic dermatitis. J Eur Acad Dermatol Venereol 2009 ; 23(11) : 1263-1266.
7 – Yosipovitch G., Papoiu What causes itch in atopic dermatitis? Curr Allergy Asthm R 2008 ; 8 : 306-311.
8 – Tominaga M, Takamori K. Recent advances in pathophysiological mechanisms of itch. Expert Rev Dermatol 2010 ; 5(2) : 197- 212.
9 – European Task Force on Atopic Dermatitis. Severity Scoring of Atopic Dermatitis : The SCORAD Index. Consensus Report of the EuropeanTask Force onAtopic Dermatitis.Dermatology 1993 ;186 :23-31.
10 – Charpin D, et al. Prévalence des maladies allergiques de l’enfant : l’enquête ISAAC-France, Phase I. BEH 1999;13:49-51.
11 – Wallach D. Marche atopique : de la théorie à la pratique. Disponible sur : https://www.fondation-derma- tite-atopique.org/fr/espace-professionnels/actualites/marche-atopique-de-la-theorie-la-pratique. Consul- té le 8 novembre 2016.
12 – Watson W, Kapur S. Atopic Dermatitis. Allergy, Asthma & Clinical Immunology, 2011;7(suppl 1):S4.
13 – ISAAC Steering Committee. Worldwide variation in prevalence of symptoms of asthma. The Lancet. 1998; 351, 1225-1235.
14 – Böhme M. et al. Family history and risk of atopic dermatitis in children up to 4 years. Clin Exp Allergy 2003; 33:1226–1231
15 – Simpson E. L., et. al. Emollient enhancement of the skin barrier from birth offers effective atopic derma- titis prevention. Journal Allergy Clinical Immunology, 134(4), 818-823.
16 – Horimukai K. et al. Application of moisturizer to neonates prevents development of atopic dermatitis. Journal Allergy Clinical Immunology. 2014;134(4), 824-830.
17 – Totté J.E.E et al. Prevalence and odds of Staphylococcus aureus carriage in atopic dermatitis: a systematic review and meta-analysis. Br J Dermatol. 2016 ; 175(4):687-95.
18 – Kong H.Temporal shifts in the skin microbiome associated with disease flares and treatment in children with atopic dermatitis. Genome Res. 2012 ; 22(5) : 850-859.
19 – Dereure O. Microbiome cutané et dermatite atopique : un second génome ? Réalités Thérapeutiques en Dermato-Vénérologie 2014 ; 237(1): 49-51.
20 – Allen H. et al. The Presence and Impact of Biofilm-Producing Staphylococci in Atopic Dermatitis. JAMA 2014 ; 150(3):260-265.